抗がん薬の開発の流れ
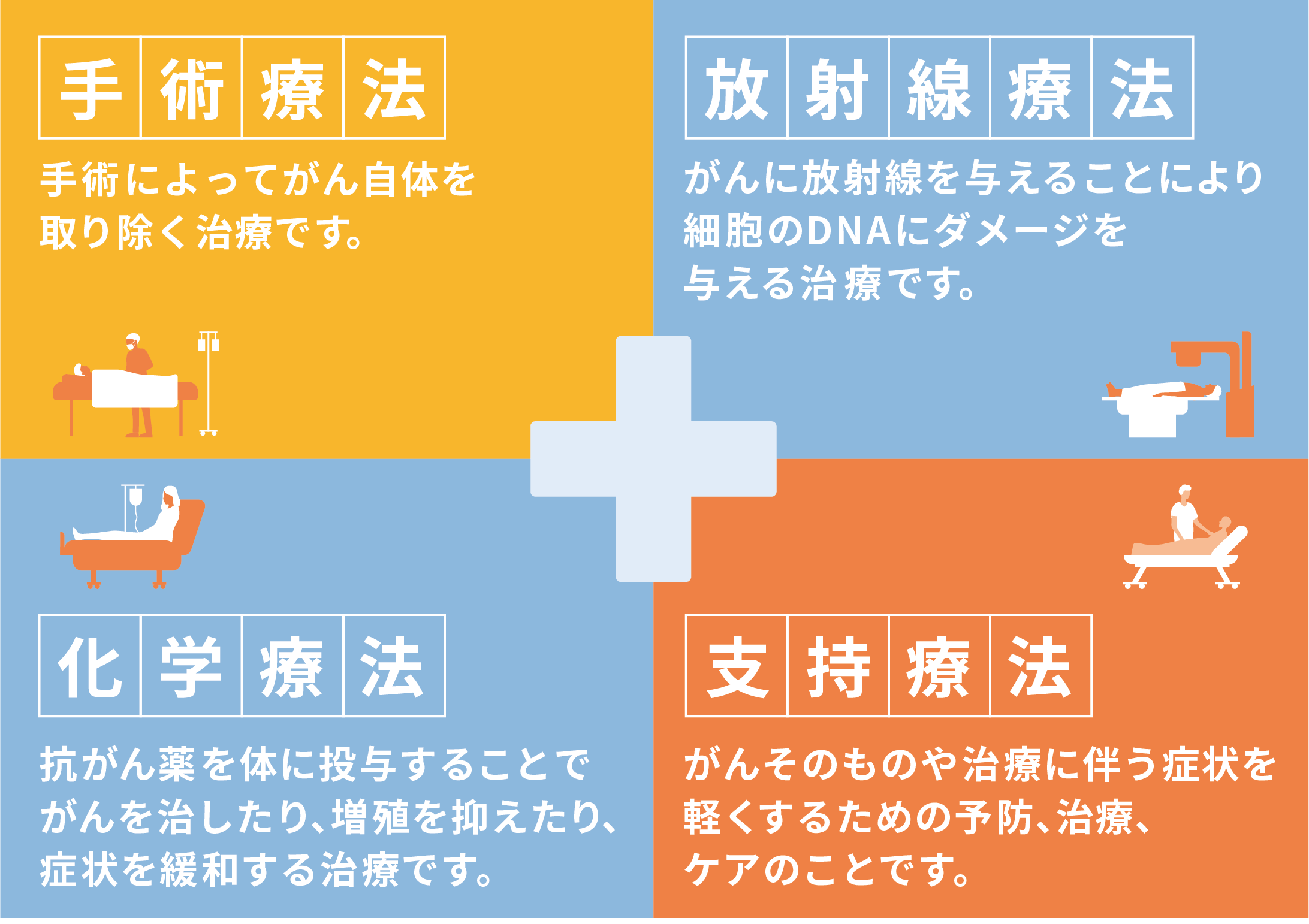
抗がん薬は、がんを治したり、あるいは、がんの進行を抑えたり、がんによる身体症状を緩和したりすることを目的として使われる治療薬です。がんの治療では手術療法、放射線療法、化学療法(ここでは抗がん薬による治療のことを総称して化学療法と表現します)、支持療法の大きく分けて4つの柱があり、抗がん薬はその一つの柱を担っています。
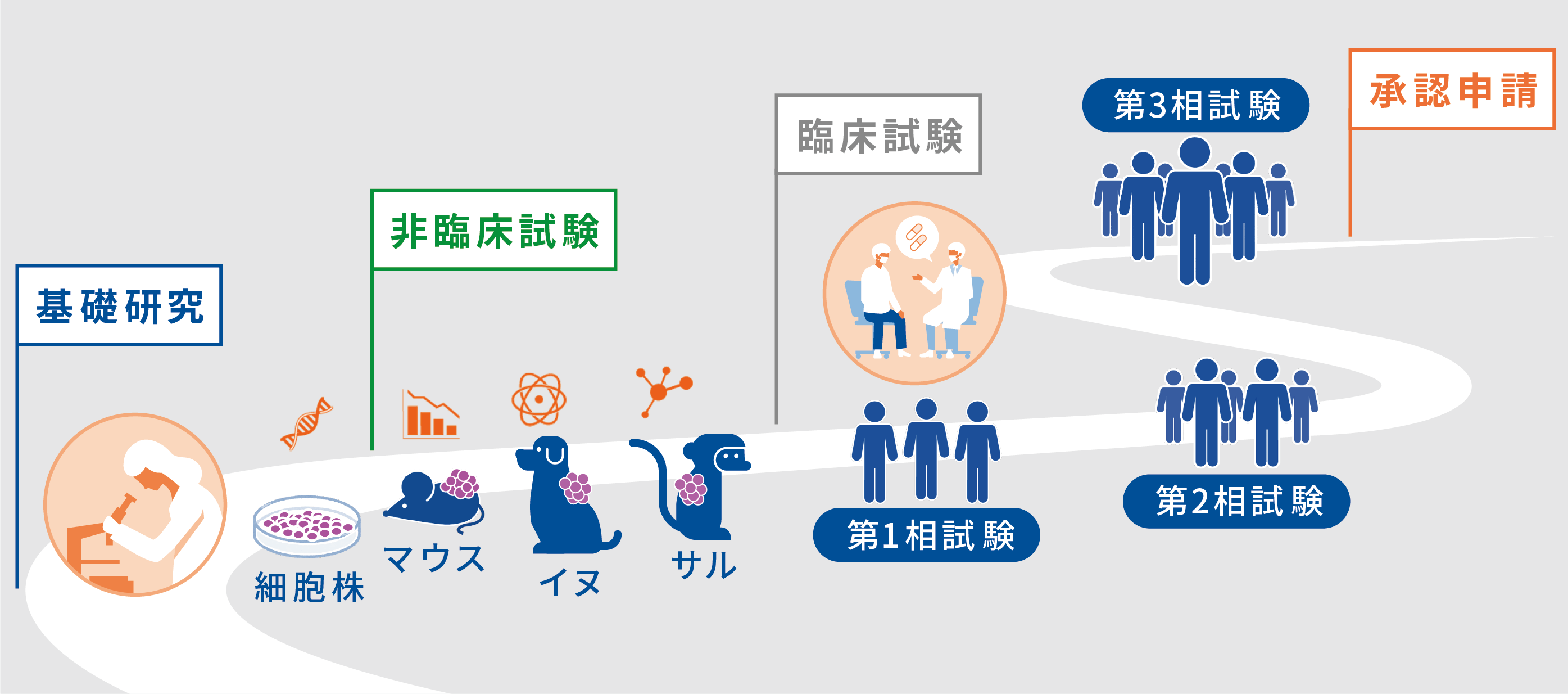
抗がん薬を作る(開発する)流れは、「非臨床試験」と「臨床試験」に大きく分けられます。非臨床試験は人に抗がん薬を投与する前に細胞や動物で実験を行う試験であり、その後の臨床試験では人に大きな副作用がないか、効果があるかの試験が行われます。
非臨床試験では、どのような標的を狙って抗がん薬を作るべきか、どのような抗がん薬で効果が期待できるか、動物に投与したときにどのような副作用が起こるか、長い間投与を続けるとどうなるか、動物の体内でどのように抗がん薬がなくなっていくか、などの研究が行われます。非臨床試験では、人に投与した場合の安全性(副作用)を十分確認するために、細胞を用いた実験を行い、その後マウスやイヌ、サルと段階を経て抗がん薬を投与する実験を行い、丹念に長い期間をかけて、その抗がん薬を本当に臨床試験へ進めるべきか、進めて良いか、を確認する試験が行われます。
細胞や実験動物での安全性が確認され、かつ効果が期待される抗がん薬は臨床試験に進みます。臨床試験は3段階に分かれ、第1相試験、第2相試験、第3相試験と順番に行われます。第1相試験は抗がん薬を初めて人に投与する試験であり、少数の患者さんを対象として、徐々に投与する量を増やしていき抗がん薬の安全性を確認し、その後の試験(第2相)で投与する抗がん薬の量を決定します。第2相試験では、第1相試験で決定された抗がん薬の量をもとに、より多くの患者さんを対象として抗がん薬を投与し、安全性の確認を行うとともに有効性(効果)を評価します。第2相試験で有効性が確認できた場合は第3相試験へ進み、多くの患者さんを対象として抗がん薬の有効性を評価し、既に販売されている抗がん薬と比べて有用性が高いか否かを評価します。第3相試験で有用性が認められた抗がん薬は、それぞれの国や地域の規制当局(日本では独立行政法人 医薬品医療機器総合機構)へ承認申請が行われます。
このような非臨床試験から臨床試験を経て抗がん薬が承認されるまでには、長い年月がかかり、経済的にも製薬企業や公的資金の負担により100億円から1000億円もの開発費用がかかります。さらに、抗がん薬は開発に成功して承認される確率が非常に低く、5%程度と言われています。つまり100個の抗がん薬を開発しても、このうち95個は安全性や有効性などの問題から承認に至らないということになります。このため、より迅速に、より安全性が高く、より有効性の高い抗がん薬を開発し、患者さんへお届けするための努力が世界中で行われています。
抗がん薬の開発が難しい理由
抗がん薬の開発が難しいことには、さまざまな理由があると推測されます。その一つとして、非臨床試験において「どのような抗がん薬で効果が期待できるか」を評価する段階が一つの課題と考えられています。
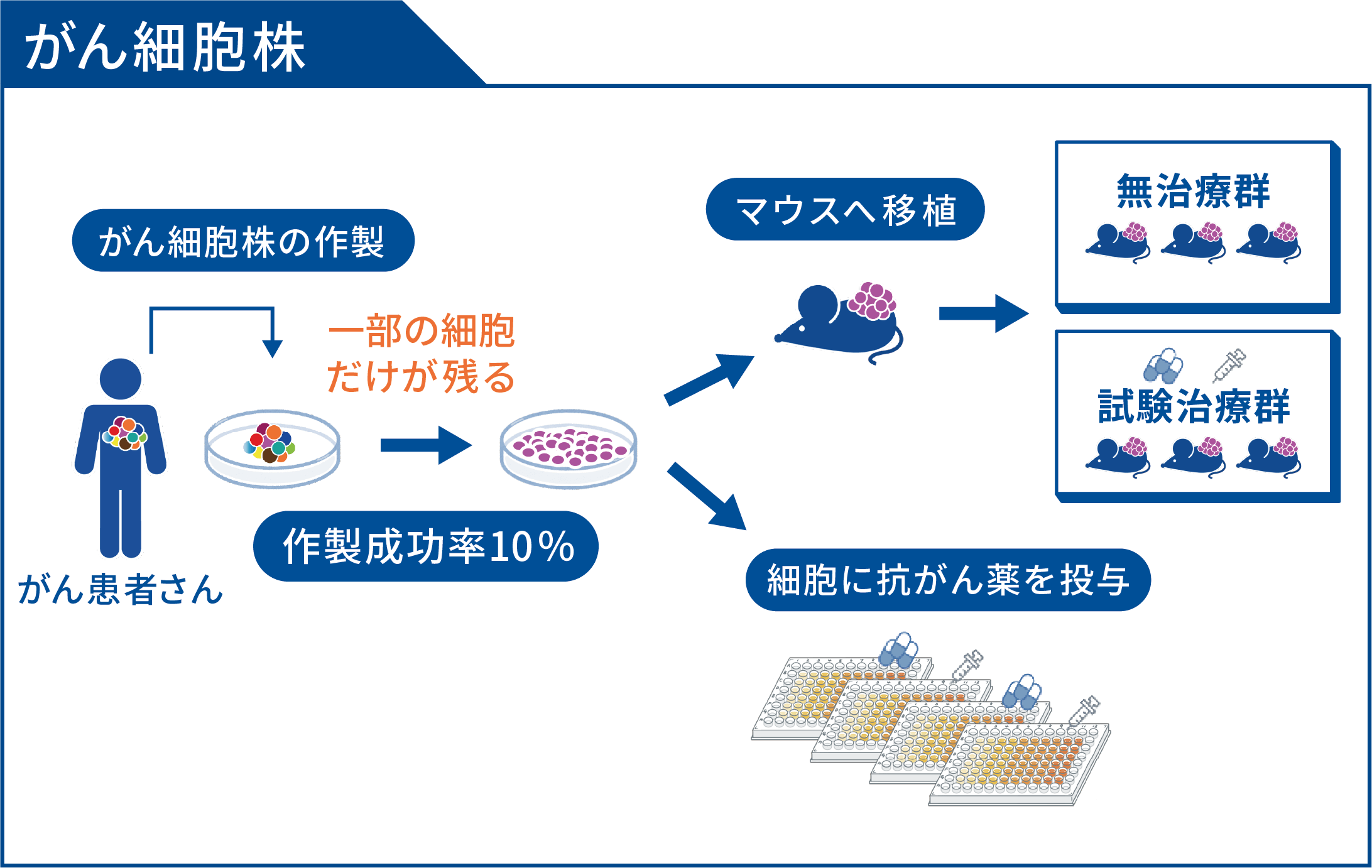
従来、抗がん薬の効果を評価するために、がん細胞株と呼ばれるがんを実験台の上で増やすことができるモデルが用いられてきました。がん細胞株は、患者さんのがん組織をお皿の上で培養液と一緒に育てることで作製されます。1990年代以降、米国国立がん研究所(NCI)が作製したNCI-60と呼ばれる60種類のがん細胞株や、日本でも複数のがん細胞株が作製されました。これらのがん細胞株に新たな抗がん薬を投与することで、どの抗がん薬からどれくらいの効果が得られるかが評価され、多くの有効性の高い抗がん薬が非臨床試験から臨床試験へと進み、承認に至っています。
しかしがん細胞株は、人工的に二次元のお皿の上で培養することから、「患者さんの体内のがん組織がそのまま再現されるわけではない」という欠点があります。がん細胞は患者さんの体内で、細胞ひとつひとつが少しずつ異なった顔つきを持っており、このようながんの特性を「不均一性」と言います。がん細胞は不均一性を持つことで、さまざまな場所へ移動(転移)したり、抗がん薬が効かなくなったりします。がん細胞株では、人工的に二次元のお皿の中で培養する過程で不均一性が失われ、お皿の中で増えやすいがん細胞だけが残ってくる場合があります。このため、がん細胞株を用いて抗がん薬を選ぶことで、実際の患者さんの体内にあるがん細胞の不均一性に有効ではない抗がん薬を選んでしまう可能性があると考えられます。
抗がん薬の開発のための新しい評価モデル
このような状況から、「患者さんの体内と同じように不均一性を保ったがん」に対して抗がん薬の有効性を評価する非臨床試験が望まれてきました。近年、このような患者さんの生体内と同じようにがんの評価をできるモデルとして、「三次元培養」や「患者腫瘍移植モデル(PDXモデル)」が注目されています。
がん細胞株は平面(二次元)のお皿の中で培養し評価を行うモデルであったのに対し、三次元培養は特殊な培養器や培養液を用いることで、培養液の中でがん細胞を三次元的に増やすことができるモデルです。三次元培養は、患者さんの体内のがんと同じようにがん細胞が増え、構造や機能も似ているため、培養器の中で比較的簡便に生体内の状況を再現できるモデルと考えられています。三次元培養の課題としては、あくまで培養器の中でがんを増やすため、がんに栄養を与える血管や、がんの周りの細胞(免疫細胞や、線維芽細胞と呼ばれるさまざまな細胞が存在し、これらは総称して「間質」と呼ばれます)は再現することが困難なことが挙げられます。
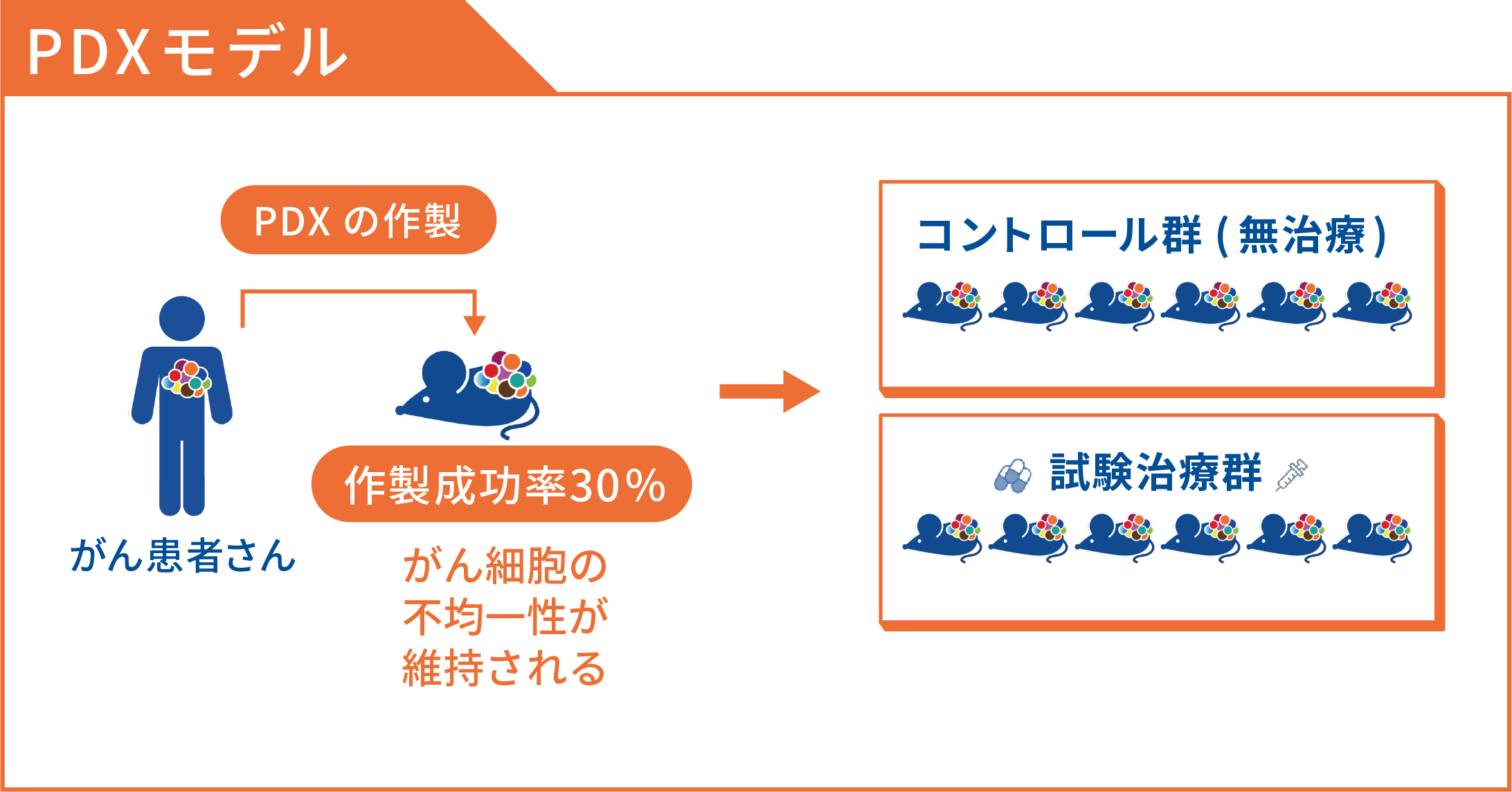
PDXモデルは患者さんのがん細胞を実験動物(免疫力を非常に抑えられたマウスが主に用いられます)に移植し、マウスの体の中でがん細胞を増やすモデルです。PDXモデルは古くから考えられてきたモデルですが、通常は人のがん細胞をマウスへ移植した場合、マウスの免疫細胞ががん細胞を攻撃するため、マウスの中でがんが増えることは困難でした。しかし2000年代より公益財団法人 実験動物中央研究所や米国ジャクソン研究所で、マウスの免疫機能を抑えたマウスが開発され、このおかげでPDXモデルが作製できる状況となりました。PDXモデルの良い点は、マウスの生体内でがん細胞を増やすことで、血管や栄養が人の体内と似た状態にできることであり、がん組織の構造や機能も人の体内に近似していると考えられています。また、がんの周囲の間質はマウスの細胞に置き換わりますが、人のがん組織に近似していると言われています。最も期待される点は、PDXモデルに抗がん薬を投与して効果を評価した結果と、患者さんに抗がん薬を投与した効果が30 ~ 80%と非常に高い確率で一致したと報告されている点です。従来のがん細胞株を使って抗がん薬を開発し承認に至る確率が5%程度であることを考えると、PDXモデルが非常に高い確度で患者さんでの抗がん薬の効果を予測できるモデルであることが期待されます。
日本人がん患者由来PDXライブラリー(J-PDXライブラリー)
国立がん研究センターでは、日本における抗がん薬の開発を促進し、より迅速により有効性が高い抗がん薬を患者さんへお届けするため、PDXモデルを用いた抗がん薬の開発研究の基盤づくりを進めています。国立がん研究センター中央病院・東病院へ通院されていらっしゃる患者さんを対象に、がん組織の一部をお預かりしてPDXモデルを作製し、2018年より「日本人がん患者由来PDXライブラリー(J-PDXライブラリー)」として抗がん薬の開発研究に活用できる体制整備を進めています。
J-PDXライブラリーはどのように利用されるか
PDXモデルは、抗がん薬の効果を評価する試験に使われることで、抗がん薬の開発を推し進める大事な基盤になります。さらに、PDXモデルではがんの不均一性が保たれているため、がんがどのようにして生まれるのか、どのようにして転移するのか、どのようにして抗がん薬が効かなくなるのか、などがんという病気の本態を明らかにする研究への利用も期待されます。
国立がん研究センターは「社会と協働し、全ての国民に最適ながん医療を提供する」ことを理念としています。患者さんのご協力のもと作製されたPDXモデルが、最適ながん医療を提供するために役立てられるよう、J-PDXライブラリーを利活用してまいります。J-PDXライブラリーは多くの大学や研究機関、製薬企業などのみなさまにご利用いただいております。
患者さんからお預かりした試料と情報
J-PDXライブラリーでは、患者さんにご協力いただきお預かりしたがん細胞からPDXモデルを作製するとともに、患者さんの臨床情報(年齢、性別、がんの種類、ステージ、どのような治療を受けられたか、治療の効果、治療の期間、臨床で行われた検査の結果など)を診療録より収集してデータベースを作成しております。
抗がん薬の開発では、どのようながんの種類の患者さんに効果があるか、どのような遺伝子の異常を持ったがんに効果があるか、どのような治療を受けられた後に効果があるのか、という「より効果が得られる可能性が高い患者さん」を見つけることが大切です。これにより、それぞれの患者さんに最適な治療を提供できる可能性を高くすることができます。臨床試験においても、非臨床試験の結果を踏まえて、開発している抗がん薬の効果が期待できる患者さんの集団を決めていきます。このため、それぞれの患者さんの臨床情報は抗がん薬の開発においてとても重要な手がかりとなります。
J-PDXライブラリーではPDXモデルを用いた非臨床試験の段階で、PDXモデルの作製のためにがん細胞を提供してくださったそれぞれの患者さんの臨床情報を踏まえて、抗がん薬の効果を評価いたします。これにより、臨床試験が始まる前や始まって早い段階で、効果が期待できる患者さんの集団を見つけることができると考えております。患者さんの臨床情報と、PDXモデルでの試験の結果を一緒に評価することで、抗がん薬の開発を加速し、新しい抗がん薬を迅速に患者さんの元へお届けできることが期待されます。
患者さんの臨床情報には、どのPDXモデルがどの患者さんから作製されたかを特定しかねない、とても重要な個人情報が含まれています。このため、国立がん研究センターだけでなく、J-PDXライブラリーをご利用いただく方も含め、個人情報が流出しないよう厳重に注意を払って取り扱います。具体的には、お預かりしたがん細胞と情報は個人を特定できないように記号化した番号(匿名化番号)により匿名化して管理され、共同で研究をおこなっている機関へ情報を提供する際も個人情報を十分に保護する契約を締結した上で管理いたします。
同意の撤回について
J-PDXライブラリーにご協力いただいた患者さんは、研究への参加に同意した後でも、いつでも同意を撤回することができます。同意を撤回されましたら、お預かりしたがん細胞と作製されたPDXモデルなどは、個人が特定されない状態でしかるべき破壊処置を施した後に廃棄いたします。ただし、保管されている未使用の試料は廃棄できますが、同意撤回の時点ですでに研究に使用されていた場合は、研究データの一部がすでに公開・共有されている可能性もあり、一般に研究データも含めた完全な廃棄は行うことができません。患者さんのがん細胞から作られたPDXモデル、PDXモデルから作製した腫瘍など(研究成果物)も、すでに国立がん研究センター外の研究者に提供されている場合は廃棄ができません。このように廃棄ができない場合でも、患者さんのがん細胞から作られたPDXモデル、研究成果物、情報などと、患者さんの氏名・カルテ番号などの個人を容易に判別する情報とを対応させる記録(「対応表」と言います)を廃棄するなどして、患者さん個人との結びつきを遮断いたします。
