抗がん薬のスクリーニング
医薬品の開発成功率は全体で約10%程度と低く、中でも抗がん薬は約5%と報告されています(1)。さらに抗がん薬の開発では標的探索から上市まで10年以上の期間と、数十〜数百億円にも及ぶ莫大な費用が必要となります(2)。このため、より迅速に、有効性と安全性が確認された抗がん薬を患者さんへ届けるため、抗がん薬の開発成功率を上昇させる手段が模索されてきました。
抗がん薬のスクリーニングは1950年代よりL1210やP388に代表されるマウスの腫瘍細胞株、1990年代以降は米国国立がん研究所(NCI)が作製したNCI-60に代表されるヒト細胞株を用いたスクリーニング系が用いられてきました(3, 4)。細胞株を用いたin vitroでの薬剤感受性試験、細胞株をマウスへ移植した細胞株移植モデル(Cell line-derived xenograft, CDXモデル)でのin vivo薬剤感受性試験が標準的な評価法として用いられ、非臨床で有効性が確認された薬剤が臨床試験へと導出されてきました。しかし、細胞株を用いた抗がん薬のスクリーニングで有効と判断されても、実際にがん患者さんで有効性を示す抗がん薬の割合は低く、このような非臨床と臨床での有効性の乖離の主な原因としては、以下のような要因が考えられています。
- 細胞株の作製段階で患者腫瘍の不均一性が失われ、一部の増殖しやすい細胞集団だけが濃縮される(不均一性の喪失)
- 細胞株の作製段階で腫瘍微小環境が失われ、腫瘍と微小環境の相互作用がなくなる(微小環境の喪失)
- 細胞株では患者腫瘍における三次元的な構造が失われ、CDXモデルでは患者腫瘍と組織構造が異なる(組織構造の変化)
- 患者腫瘍における細胞ごとの遺伝子異常が、不均一性の喪失に伴い一部の遺伝子異常が細胞株へ反映される(遺伝子異常の変化)
以上のような細胞株やCDXモデルにおける創薬開発研究の限界から、より実際の患者さんにおける抗がん薬の有効性を予測できる(臨床効果予測能の高い)スクリーニング系の構築が喫緊の課題と考えられています。
- (1). Mullard A. Parsing clinical success rates. Nature Reviews Drug Discovery. 2016;15(7):447-.
- (2). Paul SM, Mytelka DS, Dunwiddie CT, Persinger CC, Munos BH, Lindborg SR, et al. How to improve R&D productivity: the pharmaceutical industry’s grand challenge. Nature Reviews Drug Discovery. 2010;9(3):203-14.
- (3). Johnson JI, Decker S, Zaharevitz D, Rubinstein LV, Venditti JM, Schepartz S, et al. Relationships between drug activity in NCI preclinical in vitro and in vivo models and early clinical trials. Br J Cancer. 2001;84(10):1424-31.
- (4). Sausville EA, Burger AM. Contributions of human tumor xenografts to anticancer drug development. Cancer Res. 2006;66(7):3351-4, discussion 4.
PDXとは
近年、臨床効果予測能の高いスクリーニング系として、患者腫瘍由来移植 (Patient-derived xenograft, PDX) モデルが注目を浴びています。PDXモデルは、患者腫瘍組織を、培養過程を経ずにそのまま高度免疫不全マウスに移植することで作製される担がんモデルです。 PDXの作製手法は非常にシンプルであり、概念としては古くから報告されていましたが、その実用性を高めたのは、高度免疫不全マウスの開発が進んだことによります。免疫不全マウスは1960年代のnudeマウスの開発に始まり、2000年代になりT細胞、B細胞、NK細胞、IL-2受容体をノックアウトしたNOGマウス (NOD.Cg-PrkdcscidIl2rgtm1Sug/ShiJic)、NSGマウス (NOD.Cg-PrkdcscidIl2rgtm1Wjl /SzJ) がそれぞれ公益財団法人 実験動物中央研究所、Jackson研究所より樹立されました。これらの複合的免疫不全マウスが開発されたことにより、PDXモデルの樹立成功率が上昇し、抗がん薬のスクリーニング系としての実用性が高まりました。
PDXモデルで特筆すべきは、患者腫瘍における腫瘍不均一性や微小環境、組織構造が維持される点です。さらに臨床効果予測能が30〜80%と、他のスクリーニング系に比べ高いことが報告されており、創薬開発研究におけるスクリーニング基盤として期待されます(5-7)。 PDXモデルのデメリットは作製やスクリーニングを行う際のコストと期間です。PDXモデルでは必然的に免疫不全マウスが必要となるため、細胞株の作製における細胞培養液に比べコストが高くなります。また、患者腫瘍をマウスに移植してから、継代を経てPDXモデルが樹立(一般的にPDXを3回継代することで「樹立」と表現します)するまで長期間を要することから、維持管理のための人件費も増大します。
- (5). Aparicio S, Hidalgo M, Kung AL. Examining the utility of patient-derived xenograft mouse models. Nat Rev Cancer. 2015;15(5):311-6.
- (6). Gao H, Korn JM, Ferretti S, Monahan JE, Wang Y, Singh M, et al. High-throughput screening using patient-derived tumor xenografts to predict clinical trial drug response. Nat Med. 2015;21(11):1318-25.
- (7). Hidalgo M, Amant F, Biankin AV, Budinská E, Byrne AT, Caldas C, et al. Patient-derived xenograft models: an emerging platform for translational cancer research. Cancer Discov. 2014;4(9):998-1013.
(図1)CDXモデルとPDXモデルの比較
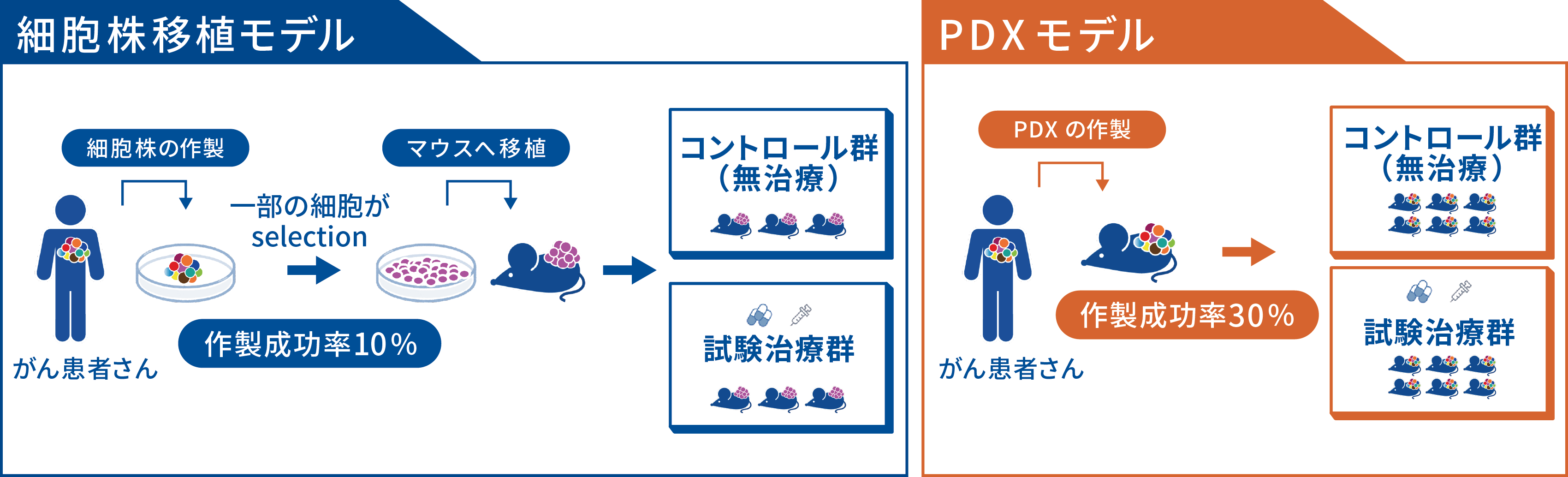
| 細胞株移植モデル | PDXモデル | ||
|---|---|---|---|
| 作製工程 | 作製成功率 / 維持 | 10%前後 / 簡便、安価 | 30%前後 / 煩雑、高価 |
| 腫瘍特性 | 元腫瘍との組織構造の対比 | 微小環境・組織構造の変化 | 微小環境・組織構造の維持 |
| 遺伝情報 | 一部のみ維持 | 多くが維持 | |
| 薬効試験 | 準備~終了までの期間 | ▼ 短期間(1~2ヶ月) | ▲ 長期間(3~12ヶ月) |
| 費用 | ▼(マウス代▼ 人件費▼) | ▲(マウス代▲ 人件費▲) | |
| データのばらつき | ▼(腫瘍が均一) | ▲(腫瘍が不均一) | |
| 薬剤の投与量 | マウスの最大耐用量で投与 | 未確定 | |
| 臨床効果予測能 | ▼(5%程度?) | ▲(30~80%?) |
諸外国のPDXライブラリーの現状
欧米では2010年代より大学や政府機関、営利団体を中心にPDXライブラリーの構築と抗がん薬スクリーニングへの活用が進められてきました。中でも米国がん研究所(NCI)は、抗がん薬のスクリーニングをNCI-60によるスクリーニングからPDXモデルへ移行するという大きな舵取りを2015年に行い、NCIを中心にアカデミアなどを含めたPDX Network (PDX-Net)を形成しています(8)。欧州では2013年にEU諸国におけるコンソーシアムとしてEurOPDXが発足し、現在までにモデル数が1,500を超えるPDXライブラリーを構築しています(8)。この他、欧米や中国で複数の開発業務受託機関 (CRO) が、抗がん薬のスクリーニングを目的としたPDXライブラリーを構築しているのが現状です。
国内では、国立研究開発法人 医薬基盤・健康・栄養研究所が古くからPDXモデルの有用性に注目し、免疫不全マウスの作製とPDXモデルの構築に取り組んでいます(9)。また、公立大学法人 福島県立医科大学では福島医薬品関連産業支援拠点化事業の一つとして福島PDX(F-PDX)モデルを構築しています(10)。
しかし、国内のPDXモデルは欧米に比べると数が少なく、充実化が求められていました。また欧米のPDXモデルは、主に早期がんの手術検体を用いて作られています。抗がん薬の開発に活用するためには、実際に抗がん薬を投与される進行・再発期のがん患者さんや、標準治療に対し抵抗性を示した患者さんの状態を反映するPDXモデルが必要です。さらに、腫瘍における遺伝子異常に人種差があることから、本邦における抗がん薬の開発を加速させるためには、日本人がん患者由来の、がん種横断的なPDXライブラリーが必要と考えられます(11)。
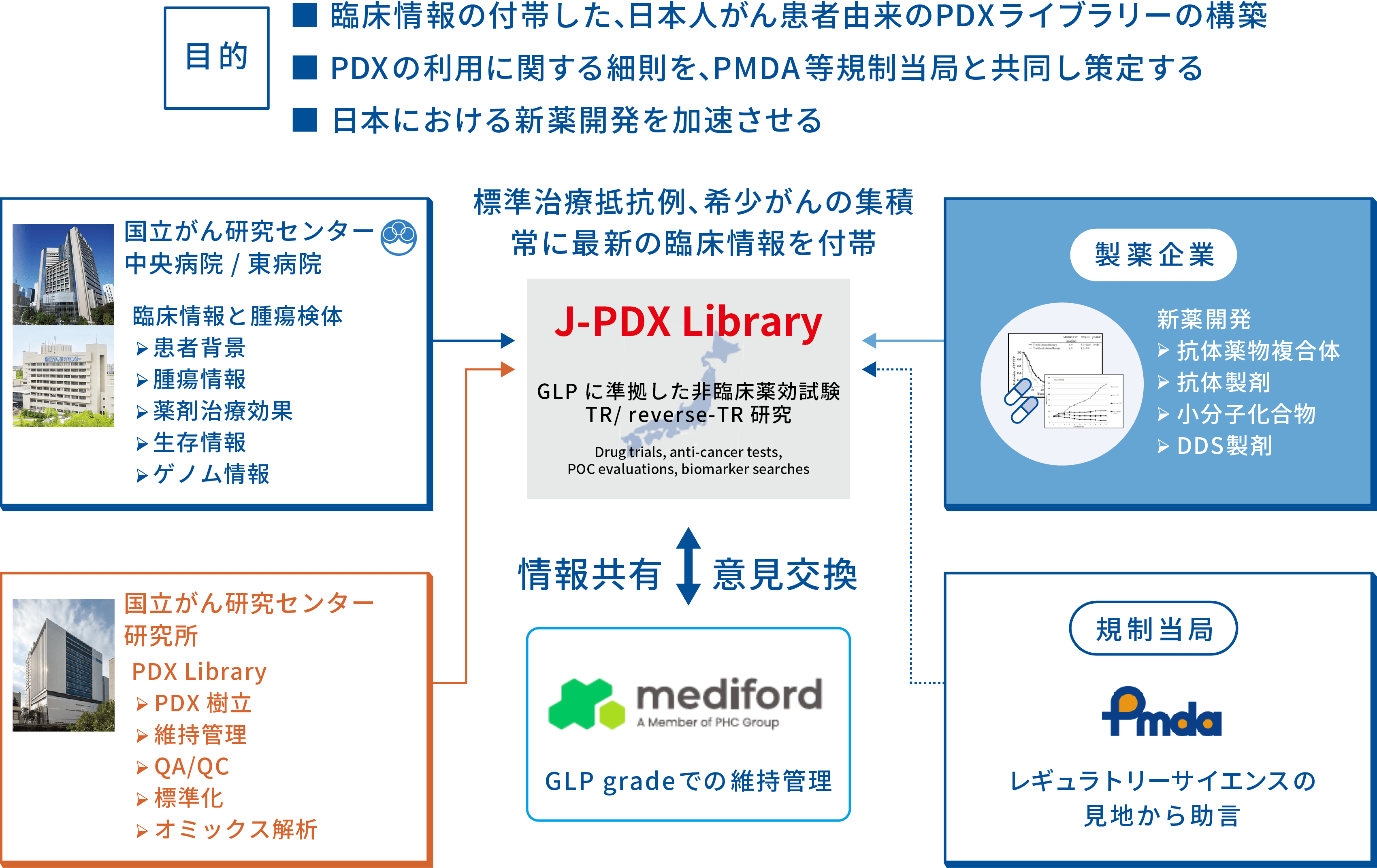
J-PDXライブラリーとその特徴
以上の背景より、国立研究開発法人 国立がん研究センターは、国立研究開発法人 日本医療研究開発機構(AMED)医療研究開発革新基盤創成事業(CiCLE)の支援のもと、株式会社LSIメディエンス(現メディフォード株式会社*)と共同で「がん医療推進のための日本人がん患者由来PDXライブラリー整備事業」として2018年よりJ-PDXライブラリーの構築を開始しました(12)。J-PDXライブラリーでは進行・再発期のがん、抗がん薬の開発が進みづらい希少がんを重点がん種とし、さらに標準治療に対し抵抗性を獲得した腫瘍の生検検体からも積極的にPDXを作製し、それぞれのモデルに詳細な臨床情報を付帯することを進めております。2022年10月末までに1,700検体を超える登録、500モデル以上の生着が得られており国内最大規模のライブラリーとなっています(図2、表1)。
- *2023年11月1日よりメディフォード株式会社に事業承継いたしました。
- (8). Meehan TF, Conte N, Goldstein T, Inghirami G, Murakami MA, Brabetz S, et al. PDX-MI: Minimal Information for Patient-Derived Tumor Xenograft Models. Cancer Res. 2017;77(21):e62-e6.
- (9). https://ahmhcdd.nibiohn.go.jp
- (10). https://www.fmu.ac.jp/home/trc/provision/f-pdx/
- (11). Saito M, Shiraishi K, Kunitoh H, Takenoshita S, Yokota J, Kohno T. Gene aberrations for precision medicine against lung adenocarcinoma. Cancer Sci. 2016;107(6):713-20.
- (12). Yagishita S, Kato K, Takahashi M, Imai T, Yatabe Y, Kuwata T, et al. Characterization of the large-scale Japanese patient-derived xenograft (J-PDX) library. Cancer Sci. 2021;112(6):2454-66.
(図2)J-PDXライブラリー
(表1)J-PDXライブラリーの特徴
| J-PDXライブラリー | 欧米のPDXライブラリー | |
|---|---|---|
| 病期 | 進行/再発期症例、希少がん | 早期 |
| 患者 | NCCの患者 | 不問 |
| 腫瘍検体 | 生検検体/手術検体 | 手術検体 |
| 前治療歴 | 標準治療抵抗例が主体 | 未治療例が主体 |
| 同意取得 | 完全取得 | 取得されていない場合もあり |
| 臨床情報 | 前治療歴 治療効果 PFS/OS 遺伝子解析結果など (臨床情報は随時アップデート) |
限られた情報 |
| PDX樹立のQA/QC | GLPに準拠 | 不問 |
J-PDXライブラリーの使命
J-PDXライブラリーは、がん患者さんへより有効性の高い抗がん薬を迅速にお届けするため、日本における創薬開発研究を加速させることが使命であると考えております。また、患者さんからお預かりした貴重な試料と情報を無駄にすることなく、多くの方に安心して利活用していただけるよう、PDXモデルの研究利用における課題整理やシステム作りも進めてまいります。
PDXを用いた創薬開発研究における課題
PDXモデルは、創薬開発研究を加速させる研究基盤として期待されます。しかしPDXモデルが比較的新しいバイオリソースであるため、品質管理、取り扱いの考え方、非臨床試験での使用方法など多くの課題が十分に整理されていません。このため、国立研究開発法人 日本医療研究開発機構(AMED)医薬品等規制調和・評価研究事業のご支援のもと「PDXモデルを用いた創薬開発研究における課題整理と標準化に関する研究」を進めております。
この研究の中では以下の3つの課題を中心に検討を進めております。
- PDXモデルという新たなバイオリソースの適正使用に必要な倫理的・法的・社会的課題(ELSI, Ethical, Legal and Social Issues)の整理
- PDXモデルの作製段階における品質管理方法の検討
- PDXモデルを用いた非臨床試験実施方法の標準化に必要な情報の収集と意見交換
検討を進めていく上で、PDXに関連する以下の関係者、研究機関や関連団体、企業様へ意見交換をお願いしてまいります。
- PDXモデルに検体をご提供いただく患者さん、ご家族、患者団体の方々
- PDXモデルを作製している研究機関や営利団体
- PDXモデルを作製するために使用する実験動物の供給機関
- PDXモデルを用いた評価を行う医薬品開発業務受託機関
- PDXモデルを用いた評価を依頼する製薬企業や業界団体
- PDXモデルから取得したデータを解釈、判断する規制当局
- PDXモデルを用いた研究を行う研究機関、基礎研究者
研究を進めていく中で、意見交換や討議を個別にご相談させていただきますので、何卒ご協力のほどよろしくお願い申し上げます。
